Обоснование
возможности использования первичных зародышевых клеток в качестве материала для
сохранения генетических ресурсов птиц
М.Т.Тагиров, Л.В.Терещенко, А.В.Терещенко
Институт
птицеводства УААН.
Резюме
В обзоре представлены убедительные доказательства
возможности использования первичных зародышевых клеток для сохранения
генетических ресурсов птиц. Проблема сохранения генома самца решается
консервацией спермы, а самки – замораживанием первичных зародышевых клеток –
предшественников сперматозоидов и яйцеклеток.
Ключевые слова: первичные
зародышевые клетки, химеры, генетические ресурсы, замораживание,
культивирование клеток.
Resume
Conclusive evidence on
capability of primordial germ cells using for poultry genetic resources
preservation are presented in the review. The problem of male genome storage is
solved by sperm cryopreservation, and female –by freezing of primordial germ
cells – precursors of ova and spermatozoon.
Key words: primordial
germ cells, chimaeras, genetic resources, freezing, cell culture.
Введение
За прошлые столетия были
созданы много местных, национальных и интернациональных пород животных. Многие
породы занимают прочные позиции благодаря определенным характеристикам, производительности или
адаптационным качествам. В настоящий момент растущее производство продуктов
питания в мире привело к уменьшению
количества международных пород, росту количества редких пород и к снижению
общего количества всех пород. Как в Европе, так и во всем мире, имеет место
генетическая эрозия, потеря или риск потери пород. В результате селекции, смены
пород или генетического дрейфа подвергается давлению как межпородное, так и
внутрипородное разнообразие.
Ex situ консервация, в частности, криоконсервация,
является важным механизмом чтобы избежать необратимых потерь пород и генов, для
воссоздания породы, для страхования наших ресурсов от санитарных катастроф, для
поддержания разведения в малых популяциях и для сохранения генетического
разнообразия (генов, свойств, пород) в селекционных
программах.
В “Руководствах
по созданию национальных программ по криоконсервации
генетических ресурсов
сельскохозяйственных животных”, разработанной в 2004 году Руководящим
Комитетом Европейского Регионального Центра
(Steering Committee of the European Regional
Focal Point (ERFP)) по генетическим ресурсам сельскохозяйственных животных, указывается,
что для птиц еще не разработаны надежные методы сохранения генетического
материала самки, и требуются дальнейшие исследования в этой области. Данный обзор имеет целью привести убедительные
доказательства в пользу того, что данная проблема практически решена за
последнее десятилетие путем использования определенных типов клеток, выделенных
из ранних эмбрионов птиц.
Состояние
проблемы сохранения генетических ресурсов птиц
Криоконсервация зародышевых клеток у птиц – способ сохранения
генетического материала для улучшения сельскохозяйственной птицы в будущем и
сохранения исчезающих видов. Для некоторых видов сельскохозяйственных птиц уже
разработаны методы криоконсервации спермы [44,1], но
консервация оплодотворенных яиц или эмбрионов, как это имеет место у млекопитающих,
до сих пор не достигнута. Главным образом, это связано с крупными размерами яиц
птиц и большим количеством желтка в них.
Восполнение данного пробела
– основная цель многочисленных работ последних двух десятилетий, изучающих клетки ранних эмбрионов птиц [2,33,42,37].
Предметом исследований в этих работах являются два типа клеток:
1.
Эмбриональные
стволовые клетки (ЭСК),
2.
Первичные
зародышевые клетки (ПЗК).
Линии ЭС клеток охарактеризованы
у мышей [13], коров [16], свиней [49], кролей [17], хомячков [7] и людей [45]. Однако,
ЭСК с доказанной трансмиссией зародышевой линии получены только у мышей [5]. Таким
образом, хотя для многих сельскохозяйственных животных и получены ЭС клетки,
они не встраиваются в линию половых клеток должным образом.
Не так давно была доказана тотипотентность первичных зародышевых клеток, которые
являются предшественниками клеток спермы и яйцеклеток. Стволовые клетки,
полученные из ПЗК, называются эмбриональными зародышевыми клетками (ЭЗК) [27,38].
У птиц, в частности, у кур,
на X стадии
развития [14], что соответствует свежеснесенному яйцу, в бластодерме имеется
немногочисленная (до 30-40 шт.) популяция клеток, обладающая тотипотентными свойствами. Эти клетки локализованы в
центральной области бластодермы. В литературе отсутствуют данные о непосредственном
выделении ПЗК на более ранних стадиях развития и их изучении, хотя и прослеживали развитие клеток, продуцирующих
куриный гомолог vasa гена (Cvh) от первого деления дробления до формирования зрелых
половых клеток [51]. Ген vasa играет
ключевую роль в формировании зародышевой линии клеток у дрозофилы.
Основная проблема,
возникающая на пути интенсивного использования ПЗК в программах по сохранению
генофонда и получению трансгенной птицы - это малое их
количество при выделении. Для решения данной
проблемы применяются различные приемы:
1. Концентрирование ПЗК в
градиенте различных веществ [50,32,24].
2. Различные методы для
уменьшения количества ПЗК эмбриона – реципиента: облучение ультрафиолетом [39],
гамма-радиацией [46], лазером [29], химическая обработка бусульфаном
[3], механическое вырезание зародышевого полумесяца [28].
3. Увеличение количества
путем культивирования ЭСК [26] и ПЗК [34]. Очень важно обеспечить
культивирование данных типов клеток в чистоте, т.е. не содержащими
включений других типов клеток. Данное условие необходимо для точного контроля за результатами исследований по замораживанию и
уровнем трансмиссии чужеродными генами при трансгенезе
птиц. Кроме того, при этом отпадает необходимость проведения процедур по
концентрированию нужной популяции клеток. Поэтому основное внимание уделяется
именно этой проблеме, проблеме культивирования эмбриональных стволових клеток, обладающих тотипотннтными
свойствами.
На рисунке 1 представлена
схема получения химер птиц по зародышевой линии клеток с использованием ПЗК, выделенных из крови
эмбрионов 13-14 стадий развития. ПЗК могут быть получены также из зародышевого
полумесяца на 7 стадии, половых бугорков на 19 стадии и гонад на 28 стадии развития.
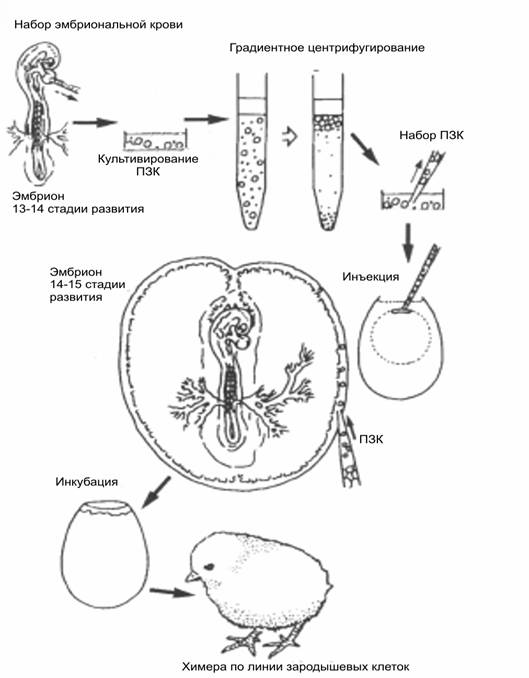
Рис.1 Последовательность процедур получения химер птиц по зародышевой линии путем трансплантации ПЗК. ПЗК, выделенные из крови, культивируются in vitro, очищают градиентным центрифугированием и инъецируются в терминальный синус эмбриона-реципиента.
Развитие первичных
зародышевых клеток и определение пола у птиц.
Оплодотворение у кур происходит в воронке яйцевода через 15 мин
после овуляции.
Формирование оси эмбриона
происходит под влиянием гравитации, когда яйцо находится в матке [15].
Последующее развитие (после
откладки яйца) происходит в скорлупе и при этом критическую роль играет разница
в плотности между желтком (1.029) и белком (1. 040) [41].
ПЗК изначально фиксируются в эпибласте в центральной области на стадии Х [18]. На стадии
Х ПЗК обнаруживаются с помощью иммуногистохимического
анализа с использованием моноклональных антител SSEA-1 и EMA-1. Из вентральной поверхности зоны пеллюцида они постепенно переходят в вентральную область
зоны гипобласта на стадии Х1-Х1V [22].
К 18 часам инкубации
(стадия 4) ПЗК перемещаются вперед в район зародышевого полумесяца (фиксируются
как йодная кислота-Шифф реакция позитивные). Оттуда они попадают в кровоток,
некоторое время находятся в кровотоке и проникают в гонады.
ПЗК, проникшие в гонады, в
случае самца, начинают активно делиться после 13 дней инкубации и
дифференцироваться в сперматогонии [19].
В возрасте около 10 недель
у цыплят сперматогонии в семенных канальцах начинают
делиться как стволовые клетки путем митоза: часть из них дает сперматогонии, а другая часть дифференцируются в первичные
сперматоциты.
Первичные сперматоциты
путем первого деления мейоза делятся во
вторичные сперматоциты и в дальнейшем в результате второго деления мейоза превращаются в сперматиды
и, наконец, дифференцируются в сперматозоиды [10].
В семенных канальцах клетки
на каждой стадии сперматогенеза переходят из периферии в просвет канальца и,
наконец, освобождается как сформированные спермии.
ПЗК, попавшие в левый
яичник эмбриона, дифференцируются для формирования оогоний
после 8 дней инкубации и начинают активно делиться в процессе дифференциации в
первичные ооциты. К 16 дням инкубации первичные ооциты входят в профазу мейоза [47].
Количество первичных
ооцитов доходит до максимума к 17 дням
инкубации [20], а затем быстро падает, возможно
благодаря апоптозу. Дальнейшая дифференциация
временно прекращается на профазе мейоза. Правая гонада прекращает развитие
после 7 дня инкубации из–за отсутствия формирования кортекса.
Возобновление развития
первичного ооцита происходит при достижении половозрелости.
Первичный ооцит выталкивает первое полярное тельце путем второго мейотического деления около 1 часа перед овуляцией и
превращается во вторичный ооцит [10]. В это время определяется, какой из
хромосом Z или W содержит вторичный ооцит, фактически происходит
генетическое определение пола эмбриона.
После овуляции происходит
оплодотворение, и вторичный ооцит выталкивает второе полярное тельце и
становится зрелой яйцеклеткой.
4-20 сперматозоидов
проникают в яйцеклетку и каждый из них формирует
мужской пронуклеус. Один из них сливается с женским пронуклеусом и становится оплодотворенным яйцом (4 часа
после овуляции).
Ароматаза, ключевой фермент в превращении тестостерона в эстрадиол-17b, играет важную роль в половой дифференциации самок [8].
Экспрессия ароматазы начинается в эмбрионе цыпленка
на 5-7 день инкубации [30]. Транскрипция
гена цитохрома Р-450arom начинается на 5-6 день инкубации у
эмбрионов только женского пола [31]. В тот же период эмбриогенеза в
гонадах эмбрионов мужского пола наблюдается експрессия
гена Sox9, характерного только для самцов [23]. Сопоставив эти данные можно заключить, что вторичное определение
пола у птиц происходит на 5-7 день инкубации. Однако, исследования последних
лет, проведенные на химерах по зародышевой линии клеток, указывают, что
первичная дифференциация ПЗК происходит в фазе их миграции к месту локализации
гонад, около 3 суток инкубации [32].
Результаты работ,
направленных на изучение генетического определения или гормонального
переопределения пола, роли зародышевых и стромальных
составляющих гонады в определении пола у птиц противоречивы.
Половая дифференциация
возникает как генетический сигнал, который трудно перекрыть гормональными
обработками [9]. Однако, в соответствующем окружении, клетки генетических
самцов могут стать оогониями и клетки генетических самок-сперматозоидами. При этом W-несущие сперматозоиды функционально неактивны.
Гонады позвоночных состоят из двух различных компонентов. Строма формируется из целомического эпителия и тканей мезонефроса, в то время как гаметы формируются из первичных
зародышевых клеток (ПЗК). Во что разовьются ПЗК- в сперму или ооциты не зависит
от их генотипа (т.е. от ZZ или ZW), а определяется типом стромы, в котором они
развиваются. У нормальных самок птиц развивается левый яичник, а правый
остается рудиментом. Удаление левого яичника приводит к пролиферации правого
яичника, но уже как семенника, продуцирующего сперму из ПЗК самок [40].
Кагами и др. [21] в 1995 году сообщили, что ПЗК генетических
самцов птиц могут дифференцироваться в функционирующие яйца и ПЗК генетических
самок – в функционально нормальные сперматозоиды. Это было показано путем анализа
судьбы бластодермальных клеток самок и самцов,
инъецированных в реципиентные эмбрионы
противоположного пола.
Приведенные данные очень
важны с точки зрения использования ПЗК в качестве материала для сохранения
генетических ресурсов птиц. Во-первых, отпадает необходимость идентификации
пола у отдельных особей на этапе сбора материала для сохранения, во-вторых, на
этапе воссоздания породы, также можно игнорировать пол эмбриона-реципиента,
куда вводятся чужеродные клетки.
Культивирование
эмбриональных стволовых клеток
Считается, что популяция ЭСК присутствует в
бластодерме эмбрионов птиц на стадии свежеснесенного яйца. Бластодермальные клетки могут заселять соматические ткани и ткани зародышевой
линии при инъекции в реципиентные
эмбрионы [36,48]. При культивировании in vitro бластодермальных клеток, выделенных из зоны пеллюцида
(центральная область) в течение 48 часов, они все еще могут встраиваться в
зародышевую линию эмбрионов-реципиентов. Однако, такая способность
культивированных клеток значительно ниже, чем у клеток,
выделенных из свежей бластодермы Х стадии развития [10,12,11]. В 1996 году Пейн и др [26] сообщили о
выделении из популяции бластодермальных клеток
эмбриональных стволовых клеток кур с множественными морфогенетическими
возможностями и поддержании их в долговременной культуре. Для того чтобы
охарактеризовать эту популяцию клеток, была использована среда, содержащая
факторы роста: базовый фактор роста фибробластов (basic fibroblast growth factor (bFGF)), фактор стволовых клеток (stem cell factor (SCF)), инсулиноподобный
фактор роста (insulin-like growth
factor-1 (IGF-1)) и цитокины: фактор ингибиции
лейкемии (leukemia inhibitory factor (LIF)) и интерлейкин-11 (interleukin-11 (IL-11)). По морфологии культивируемые бластодермальные
клетки круглые и маленьких размеров; у них сильная активность щелочной
фосфатазы и они узнаются антителами ECMA-7, SSEA-1, SSEA-3, EMA-1. Все эти свойства характерны также эмбриональным
стволовым клеткам мышей. После удаления LIF клетки становятся плоскими, скорость роста снижается и они теряют антигенные
детерминанты (эпитопы) узнаваемые ECMA-7, SSEA-1, SSEA-3, EMA-1. При инъекции в реципиентные
эмбрионы культивируемые клетки формировали
фенотипические химеры, количество которых не зависел от продолжительности культивирования.
Бластодермальные клетки можно поддерживать до 20
пассажей без потери характерных свойств стволовых клеток
и они могут формировать эмбриоидные тела в течение
всего периода культивирования. Эмбриоидные тела могут
быть индуцированы к дифференциации в гемопоэтические клетки, мышечные клетки и
нервные клетки, указывая, что они содержат стволовые клетки, по крайней мере, эктодермальной и мезодермальной
линий.
В результате этих
исследований, при инъекции клеток 7-дневной культуры в реципиентные
эмбрионы были получены химеры по зародышевой линии клеток, а при более
длительном культивировании эта способность теряется.
Культивирование
первичных зародышевых клеток
Линии эмбриональных
зародышевых клеток (ЭЗ) полученные из примордиальных
зародышевых клеток (ПЗК) представляют собой недифференцированные, плурипотентные стволовые клетки. До настоящего времени
эмбриональные зародышевые клетки с доказанной трансмиссией зародышевой линии
получены только у мышей.
Аллиоли и др. [4] в 1994 году впервые сообщили, что ПЗК кур, выделенные из гонад, могут развиваться в условиях in vitro в течение нескольких дней. Чанг и др. [6] удачно культивировали гонадные
ПЗК в течение 5 суток на стромальных клетках из
зародышевых бугорков и получил химер по зародышевой линии клеток.
В 2000 году Парк и др. [35] впервые выделили
ПЗК из гонад 5,5 суточных эмбрионов и получили линию предполагаемых ЭЗ клеток
кур в специально разработанной среде культивирования, обогащенной ростовыми
факторами. Эти клетки росли в течение 4 месяцев на фидерном слое митотически активных фибробластов эмбрионов кур. При
скрининге через несколько пассажей с использованием йодная
кислота-Шифф реакции и против антител SSEA-1 эти клетки сохраняли свойства, характерные для гонадных ПЗК и недифференцированных стволовых клеток. При
культивировании в суспензии ЭЗ клетки
формировали эмбриоидные тела и дифференцировались в
различные типы клеток. При инъекции ЭЗ клеток в подзародышевую
область бластодермы были получены химеры по различным соматическим тканям
организма.
В более поздней работе эти
авторы усовершенствовали свой метод культивирования гонадных
ПЗК [34]. В качестве фидерного слоя клеток вместо эмбриональных фибробластов использовали
клетки эмбриональных гонад, а инъекцию ЭЗК осуществляли не в бластодерму, а в
кровоток 2,5 суточных эмбрионов. Для
культивирования ПЗК использовали смешанную популяцию стромальных
клеток гонад и гонадные ПЗК. Стромальные
клетки быстро пролиферируют и формируют монослой. ПЗК
начинают формировать колонии на фидерном слое стромы на 7-день культивирования.
Авторы также изучали влияние концентрирования клеток в градиенте фикола
и процесса культивирования на процент химеризма.
Показано, что обработка фиколом негативно влияет на
изученные показатели, и наблюдалось достоверное увеличение процента полового химеризма при инъекции культивированных в течение 10 дней ПЗК
по сравнению с 0-5 дневным культивированием (0,6-7,8% против 10,7-49,7%).
Следует отметить, что, хотя
многие исследователи и пользуются для разделения популяции ПЗК от стромальных клеток гонад или от клеток крови методом
градиентного центрифугирования, разработанного Йасуда
и др. [50], в последнее время появляются сообщения о неэффективности или даже
негативном влиянии данного подхода на результативность химеризма
по зародышевой линии клеток [50, 25]. Возможно, это связано с тем, что в
результате неоднократных операций центрифугирования, ПЗК претерпевают значительные
повреждения.
Замораживание
ПЗК птиц.
Криоконсервация первичных зародышевых клеток (ПЗК) обеспечивает
альтернативный подход сохранения, как генетического материала самок, так и
самцов. Криоконсервированные ПЗК могут дать начало
живым потомкам через химер по половой линии клеток [43].
Бластодермальные клетки, выделенные из свежеснесенных яиц (Х стадия)
были заморожены в жидком азоте перед инъекцией в эмбрионы-реципиенты для
получения химер птиц [37]. Живые потомки были получены от химер зародышевой
линии путем переноса заморожено-оттаянных бластодермальных
клеток в эмбрионы-реципиенты [24]. Процент химерних особей
был значительно ниже (8-10%), чем при использовании свежих бластодермальных
клеток (56%)
Наито и др
[33] в 1994 году впервые удачно заморозили ПЗК до температуры жидкого азота. ПЗК, выделенные из эмбриональной крови, замораживались под защитой
10% диметилсульфоксида.
Замороженные клетки хранились в жидком азоте в течение 5 месяцев. После
оттаивания выживаемость клеток была на уровне 94%. Заморожено-оттаянные ПЗК
были инъецированы в частично стерильные реципиентные
эмбрионы, в результате чего были получены химеры по зародышевой линии клеток.
Поскольку методы культивирования ПЗК еще не были разработаны, концентрация ПЗК
в среде замораживания была очень низкой. Несмотря на это ПЗК показали высокую
толерантность к замораживанию. Удаление части крови из эмбриона-реципиента
перед инъекцией донорских клеток увеличил количество потомков, производных от
донора.
ПЗК, выделенные из гонад 5
суточных эмбрионов, также были заморожены и получены химеры зародышевой линии [42].
Результаты работ как по криоконсервации бластодермальных
клеток, так и ПЗК, свидетельствуют о
том, что процент особей, химерных по линии зародышевых клеток значительно ниже, чем
таковой по соматическим клеткам. Данный факт, скорей всего, обусловлен тем, что
условия криоконсервации,
разработанные для общей популяции бластодермальных
клеток, не совсем подходят для клеток зародышевой линии. Разработка методов
культивирования и селекции ПЗК в чистоте позволит выбрать оптимальные для них режимы и условия
замораживания.
На рисунке 2 представлена
схема воссоздания породы из заморожено- оттаянных бластодермальных клеток на Х стадии развития. Для инъекции
в эмбрионы-реципиенты также могут быть использованы ПЗК, выделенные из
зародышевого полумесяца на 7 стадии, из крови эмбрионов на 13-14 стадии,
половых бугорков на 19 стадии и гонад на
28 стадии развития.
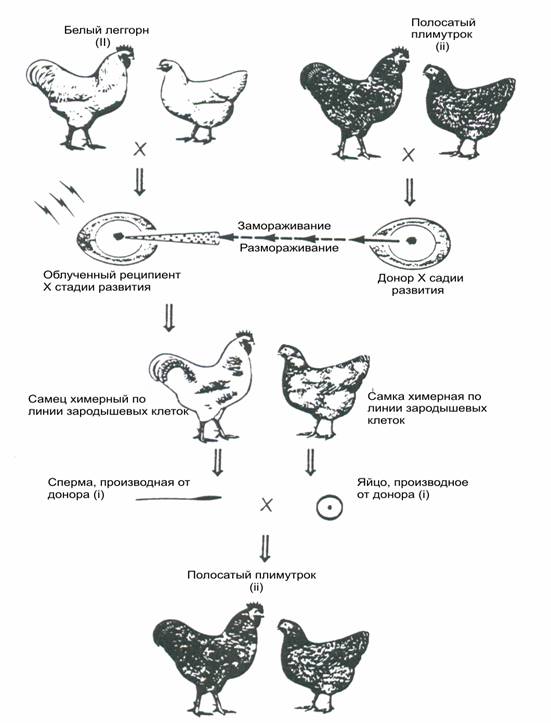
Рис. 2 Стратегия
консервации генетических ресурсов птиц, с использованием химер по зародышевой линии
клеток. Бластодермальные клетки получают от эмбрионов
породы полосатый плимутрок Х стадии развития. Замораживают, хранят,
размораживают и инъецируют в эмбрионы Х стадии развития породы белый леггорн.
После инкубации химерных самок и самцов выращивают до
половозрелости. При скрещивании между собой химеры по
половой линии клеток дают потомство, полностью производное от донора.
Выводы
1. У птиц охарактеризованы
специфические типы клеток (эмбриональные стволовые клетки и первичные
зародышевые клетки), которые при
определенных условиях могут развиваться в яйцеклктки
и/или сперматозоиды. Эти клетки встраиваются в зародышевую линию клеток эмбрионов-реципиентов,
что позволяет восстановить исходный генотип при скрещивании химерных
организмов.
2. У птиц гетерогаметным
является самка. Генетическое определение пола у птиц происходит непосредственно
перед овуляцией в результате второго мейотического
деления первичного ооцита. Во что разовьются первичные зародышевые клетки
генетических самок или самцов полностью определяется генотипом стромальной составляющей гонады.
3. Методы культивирования
первичных зародышевых клеток позволяют увеличить их количество in vitro, сохраняя
морфогенетические свойства тотипотентных стволовых
клеток. Это дает возможность разрабатывать режимы и условия замораживания,
специфические для данных типов клеток с целью повышения эффективности криоконсервации.
4. Положительные результаты замораживания ПЗК при
применении условий криоконсервации, разработанных для
соматических клеток, свидетельствуют о значительной их толерантности к
замораживанию и потенциальной возможности усовершенствования данных методов.
5. При инъекции заморожено-оттаянных ПЗК,
выделенных от одной породы, в эмбрионы-реципиенты другой породы получены химерные особи по зародышевой линии клеток. При скрещивании
данных особей между собой воссозданы особи исходной донорской породы, что
свидетельствует о возможности использования ПЗК в качестве материала для
сохранения генетических ресурсов птиц.
Литература
1.
Бичко С.В., Артеменко О.Б., Терещенко О.В. 2003 Кріоконсервування сперми
гусаків під
захістом диметилформаміду і діолів // Птахівництво:
Міжвід. темат. наук. зб.(Матеріали
IV Української конф. по птахівництву з міжнарод. участю, 15-19 вересня, 2003 р.) . - Харків,
2003. – Вип.53. – С.27-32.
2.
Терещенко А.В.,
Тагиров М.Т., Белецкая А.В., Артеменко А.Б., Сахацкий
Н.И. 1993 О возможности получения
инъекционных химер кур // С.- х. биология. - 1993. - N 2. - С. 48-50.
3. Aige-Gil V.;Simkiss K. 1991 Sterilisation of avian embryos with busulphan.
Research in Veterinary Science 50,139-144.
4. Allioli N.,
Thomas J., Chebloune Y., Nigon
V., Verdier G., Legras C.
1994 Use of retrovial vectors to introduce and
express the β -galactosidase
marker gene in cultured chicken primordial germ cells. Dev Biol
165, 30-37.
5. Bradley A., Evans
M., Kaufman M.N., Robertson E. 1984. Formation of germ-line chimaeras from
embryo-derived teratocarcinoma cell lines. Nature
302: 255-256.
6.
7. Doetschman T.C., Williams P.,
Maeda N. 1988. Establishment of hamster blastocyst-derived
embryonic stem (ES) cells. Dev. Biol. 127:224-227.
8. Elbrecht A., Smith G.G
(1992) Aromatase enzyme activity and sex determination in chickens.
Science 225: 467- 470.
9. Etches R.J.,.Kagami H Genotypic and
phenotypic sex reversal Vl International Symposium on Avian Endocrinology March 31-
10. Etches R.J.;
11. Etches R.J.;
12. Etches R.J.; Fraser R.M.;
13. Evans M.J., Kaufman
M.N. 1981. Establishment in culture of pluripotential
cells from mouse embryos. Nature 292: 154-156.
14. Eyal-Gilad H.;
Kochav S. 1976 From cleavage to primitive
streak formation: A complementary normal table and a new look at the first
stages of the development of the
15. Eyal-Giladi H.
1984 The gradual establishment of cell commitments
during the early stades of chick development. Cell
Differentiation 14, 245-255.
16. First N.L ., et.al.,1994. Systems for production of calves from
cultured bovine embryonic cells. Reprod. Fertil.Dev. 6: 553-562.
17. Giles J.R., et.al. 1993. Pluripotency of
cultured rabbit inner cell mass cells detected by isozyme
analysis and eye pigmentation
of fetuses following injection into blastocyst
or morulae. Mol. Reprod.
Dev. 36: 130-138.
18. Ginsburg M. 1994 Primordial germ cell formation in birds. In: Ciba
Foundation Symposium 182, Germline Development.
19. Howarth B.
1995 Physiology of reproduction: the male. In: Poultry Production (edited by Hunton P.).
20. Hughes G.C. 1963 The population of germ cells
in the developing female chick. Journal of Embryology and Experimental Morphology 11, 513-536.
21. Kagami H., Clark M.E., Verrinder Gibbins A.M. &
Etches R.J. 1995 Sexual differentiation of chimeric
chickens containing ZZ and
ZW cells in the germline. Molecular Reproduction and Development, 42,
379-387.
22. Karagenc L.;
Cinnamon Y.; Ginsburg M.; Petitte J.N. 1996 Origin of
primordial germ cells in the prestreak chick embryo.
Developmental Genetics 19, 290-301.
23. Kent J., et.al. 1996 A mail-specific role for SOX9 in vertebrate
sex determination. Development 122: 2813-2822.
24. Kino K., Pain B., Leibo S.P., Cochran M.,
25. Li B.C. et. al. 2005 Suitable stages for isolation and culture PGCs from chicken embryos. International Journal of Poultry
Science 4 (11): 885-890.
26. Long term culture
and characterization of avian embryonic stem sells with multiple morphogenetic
potentialities. B.Pain, M.E.Clark,
R.J.Etches, J.Samarut. Vl
International Symposium on Avian Endocrinology March 31-April 5, 1996 Chateau
27. Matsui Y, Zsebo K, Hogan BL. 1992. Derivation
of pluripotential embryonic stem cells from murine primordial germ cells in culture. Cell 70:841-847.
28. McCarry J.R.;Abbott
29. Mims M.F.; McKinnel R.G. 1971 Laser
irradiation of the chick embryo germinal crescent. Journal of Embryology and
Experimental Morphology 26,31-36.
30. Mizuno S., et.al. 1993 Sex-specific DNA sequences in galiformes and their application to the study of sex differentiation. In
“Manipulation of the Avian Genome”
31. MkPhaul M.J., et. al. 1988 The expression of a
functional cDNA encoding the chicken
cytochrom-450arom (aromatase) that catalyzes the
formation of estrogen from endrogen. J.Biol. Chem 263: 16358-16363.
32. Naito M. et. al. 2004 Migration of primordial germ cells isolated
from embryonic blood into the gonads after transfer to stage X blastoderms and detection of germline
chimaerism by PCR. British Poultry Science, v. 45, N:6, pp: 762-768.
33. Naito M., Tajima A., Tagami T., Yasuda Y., Kuwana T. 1994 Preservation of chick primordial germ cells
in liquid nitrogen and subsequent production of viable offspring. Journal of
Reproduction and Fertility 102, 321-325.
34. Park et. al. 2003 Improved germline transmission in chicken chimeras produced by
transplantation of gonadal primordial germ cells into
recipient embryos. Biology of Reproduction 68: 1657-1662
35. Park T. S and Han
J.Y. 2000 Derivation and characterization of pluripotent
embryonic germ cells in chicken. Molecular Reproduction and Development 56:
475-482.
36. Petitte J.N.,Karagenc L. 1996 Growth
factors during early events in avian
embryo development. Poultry and Avian Biology Reviews 7, 75-87.
37. Reedy S.E., Leibo S.P.,
38. Resnick JL, Bixler
LS, Cheng L, Donovan PJ. 1992.
Long-term proliferation of
mouse primordial germ cells in culture. Nature 359:550-551.
39. Reynaud, G.
1976 Reproductive capacity and offspring of chickens submitted to a transfer of
primordial germ cells during embryonic life. Roux’s Archives of Developmental
Biology 179,85-110.
40. Simkiss K. Asimmetrical Germ Cell Commitment in the avian Gonad Vl International Symposium on
Avian Endocrinology March 31-
41. Suda T.;Abe
E.; Katagiri T.; Yokose S.; Yoshiki S.; Horikawa H.; Cohen G.W.; Naito M. 1994 The role of gravity
in chick embryogenesis. FEBS Letters 340, 34-38.
42. Tajima A., Naito M., Yasuda Y., Kuwana T. 1998 Production of germ-line chimeras by
transfer of cryopreserved gonadal
primordial germ cells (gPGCs) in fowl. Journal of
Experimental Zoology 280, 265-267.
43. Tajima, A., et. al. 1996 Production of germ-line chimeras by transfer of cryopreserved
gonadal primordial germ cells (gPGCs)
in chicken. Proc. 20th World’s Poult.
Cong., 1:385-388.
44. Tereshchenko A.V., Artemenko A.B., Sakhatsky N.I.
1992 Criopresevation of chicken semen // Proceedings
of the 12th international congress on animal reproduction, 23-27 august 1992, -
Hague, Netherland,1992.- V.3. - P. 1602-1604.
45. Thomson J.A., et
al. 1998. Embryonic stem cell lines derived from human blastocysts.
Science 282: 1145-1147.
46. Thoraval P.;
Lasserre F.; Coudert F.;Dambrine G. 1994 Somatic and
germ-line chicken chimaeras obtained from Brown and White Leghorns by transfer
of early blastodermal cells. Poultry Science 73,
1897-1905.
47. Ukeshima
A.1994 Abandonment of germ cells in the embryonic chick ovary: TEM and SEM
studies. Anatomical Record 240, 261-266.
48. Watanabe M.; Kinutani M.; Naito M.; Ochi O.;
Takashima Y. 1992
Distribution analysis of transferred donor cells in avian blastodermal chimeras. Development 114, 331-338.
49. Whiller N.B. 1994.
Development and validation of swine embryonic stem cells. Reprod.
Fertil. Dev. 6: 563-568
50. Yasuda Y, Tajima A,
Fujimoto T, and Kuwana T. 1992 A method to obtain avian
germ-line chimaeras using isolated primordial germ cells. Journal of Reproduction and Fertility 96:
521-528.
51. Tsunekawa N, et.al. 2000 Isolation of chicken vasa
gomolog gene and tracing the origin of primordial
germ cells. Development 127: 2741-2750.

