| Репродукция птиц:
Формирование половых продуктов птиц |
 |
| Репродукция птиц:
Формирование половых продуктов птиц |
 |
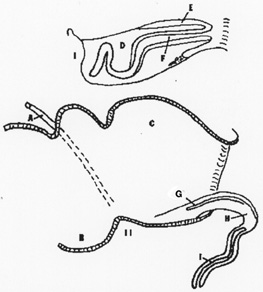
Миграция первичных зародышевых клеток птиц:
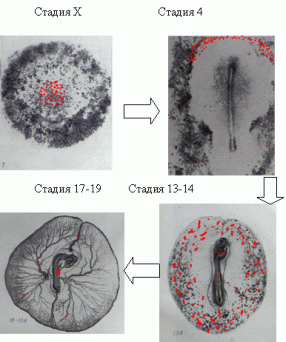
Рисунок 1. Миграция первичных зародышевых клеток в раннем эмбриогенезе птиц (пояснения в тексте).
Формирование спермы
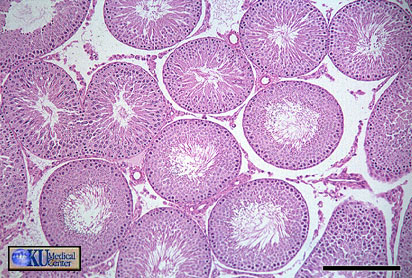

Микрофотография среза семенников, показывающая
семенные канальцы в ходе полного
формирования семени. SG показывают сперматогонии; PS, первичные спематоциты; Ss, вторичные
сперматоциты;
MS, зрелый спематоцит; and L, просвет канальца
(начальное увеличение Ч800) (Samour 2002).
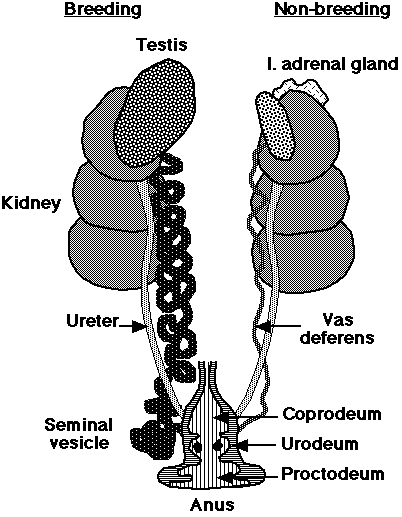
| Самцы птиц имеют парные абдоминальные семенники, занимающие краниовентральное
положение к первой доле почек. Размеры семенников быстро увеличиваются в ходе племенного сезона.
Vas deferens возникает посередине и проходит каудально к клоаке, где имеет общий с
мочеточником выход в часть клоаки, называемый Urodeum. Терминальный конец vas deferens набухший вследствие
хранения спермы: семенной клубок (или семенной пузырек).
Как и у млекопитающих, формирование спермы-процесс зависящий от температуры, и созреванию способствует ночное падение температуры, или же развитием мошонки (внешняя терморегуляция), содержащей семенной клубок. Кроме того, самцы птиц имеют сравнительно маленький запас внегонадной спермы и она еякулируется вскоре после формирования в семенниках. |
|

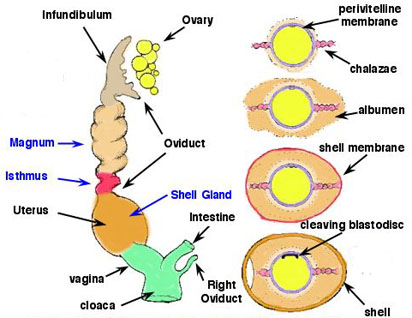
Яичник птиц Источник: http://www.ksvea.com/birds.html) |
 Источник: ulisse.cas.psu.edu/4hembryo/female.html |

Источник: ulisse.cas.psu.edu/4hembryo/female.html |
| В сезон размножения яичник значительно увеличивается. Активные яичники схожи на
грозди винограда – развивающиеся фолликулы. Яйцевод открывается воронкой медиально к яичнику. Овуляция приводит к освобождению
яйца из зрелого фолликула на поверхности яичника. Яйцо, с большим количеством запасных питательных веществ в форме
концентрических слоев желтка,
захватывается воронкой и потоком ресничек направляется в белковый отдел яйцевода.
Более трех часов яйцо окружается белком. Яйцо затем поступает в перешеек, где формируются подскорлупные мембраны. На это уходит около одного часа. Яйцо затем движется в матку, или скорлуповую железу, где добавляется известковая скорлупа и, у некоторых птиц, добавляется пигмент. Яйцо затем проходит во влагалище и клоаку для откладки. |
|
Самки могут влиять на
пол своих цыплят.—У некоторых видов птиц, какое яйцо отложит птица (самку или самца)
зависит от того, какой пол имеет больше шансов процветать. Rutstein et al. (2004) регулировал прием пищи у самок и самцов зяблика и установил,
что при хорошем кормлении самки больше склонны давать дочерей, в то время как, при плохом кормлении - сыновей.
Такой результат может исходить из того факта, что потомство самок необходимо кормить лучше,
чем самцов для выживания и роста. 
Авторы отмечают, что у многих животных соотношение полов приближается к 50:50 и очень тяжело изменить его. У млекопитающих, включая человека, пол ребенка определяется тем, какая половая хромосома в сперме. Но у птиц, яйцо самки, а не сперма самца определяет пол цыпленка. Таким образом, самка определяет, яйцо самки или самца овулируется. В некотором роде, самка зяблика, казалось бы, может повлиять на пол птенцов в зависимости, от того, какой из них имеет больше шансов на выживание. "Исследования говорят нам, что они это делают, и мы понимаем почему. Основной вопрос заключается в том: как они это делают" У многих животных, самки нуждаются в хорошем кормлении и хороших условиях, если они должны давать потомство, так как яйца стоят очень дорого для организма. Из больших яиц вылупляются большие птенцы, у которых больше шансов на выживание. Такое ‘регулирование соотношения пола’ хорошо регистрировано у некоторых насекомых, таких как пчелы, осы, но значительно менее понятна у птиц и млекопитающих. Птицы являются хорошей моделью для изучения регулирования полового соотношения, так как пол птенцов можно определить сразу после отложения яйца при помощи молекулярных методов. Более того, все ресурсы, необходимые для развивающегося эмбриона, находятся в яйце при отложении. Таким образом, размер и содержимое яйца являются мерой запасных веществ, которых самка вложила в яйцо, что в свою очередь влияет на последующее выживание. |
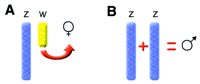
Два потенциальных механизма, определяющих пол у птиц (A) the присутствие W хромосомы запускает саочный тип или (B) присутствие двух Z хромосом определяет самцовый тип. |
Определение пола у птиц (Ellegren 2001) – Молекулярные механизмы, лежащие в основе определения пола у птиц до сих пор остаются загадочными. Этот процесс отличается от таковой у млекопитающих. У птиц не найдены гены гомологичные таковым, какие отвечают за самцовый тип у млекопитающих.
Эта ситуация, вероятно, является отражением того факта, что, несмотря на присутствие двух полов практически во всем животном царстве, задействованные гены практически не связаны у разных классов многоклеточных организмов. Эти различия вызывают трудности для сравнительного анализа кандидатных генов в исследованиях полового развития.
У птиц самки – гетерогаметный пол, с одной копией Z и W половых хромосом. Самцы гомогаметны (ZZ). Однако, не ясно, то ли присутствие W хромосомы, характерной для птиц, запускает развитие самки, или же доза Z хромосомы определяет самца. Еще одной интригующей возможностью является то, что и Z, и W хромосомы играют роль в определении пола птицы! Например, у сумчатых животных, Y действует как хромосома, определяющая семенники, в то время как, X хромосома определяет выбор между мешком и мошонкой. Возможно, у птиц тоже используется система, где две половые хромосомы разделяют различные аспекты половой дифференциации. |
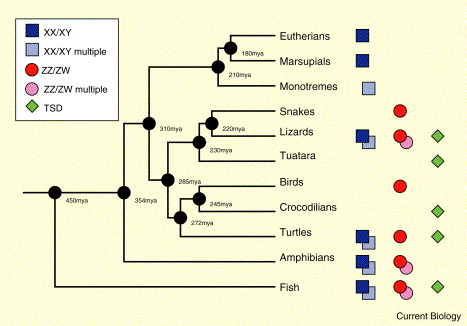
Системы определения пола у позвоночных. Филогения основных монофилетических таксонов позвоночных, показывающая системы, определяющие пол
‘Multiple’
показывает подключение более чем одной пары хромосом в определении пола.
TSD: температуро-зависимое определение пола (From: Ezaz 2006).
Температура инкубации и соотношение полов у птиц -- Хотя у рептилий это и обычное явление, температура инкубации считается фактором, не оказывающим влияние на соотношение полов  у птиц. Однако, Goth и Booth (2005) обнаружили, что температура инкубации
действительно оказывает влияние на соотношение полов у сорных кур (megapodes), какие
отличаются от остальных птиц тем, что используют тепло из окружающей среды для инкубации яиц.
УАвстралийских
Brush-turkey (Alectura lathami), сорных кур, строящих кучи, при низких температурах вылупляются самцы, а при высоких- самки, в то время как при средней температуре в кучах в природных условиях соотношение равно 1:1. Цыплята при низких температурах весят меньше, что, вероятно, сказывается на выживаемости потомства. Megapodes имеют гетероморфные половые хромосомы как и другие птицы, что исключает температуро-зависимое определение пола, какое описано у рептилий, как механизмa смещающей половое соотношение при высоких и низких температурах. Взамен, Goth и Booth (2005) предполагают наличие температуро-чувствительной смертности эмбрионов, поскольку смертность была выше при низких и высоких температурах, и минимальной при средней температуре, при которой половое соотношение было 1:1.
у птиц. Однако, Goth и Booth (2005) обнаружили, что температура инкубации
действительно оказывает влияние на соотношение полов у сорных кур (megapodes), какие
отличаются от остальных птиц тем, что используют тепло из окружающей среды для инкубации яиц.
УАвстралийских
Brush-turkey (Alectura lathami), сорных кур, строящих кучи, при низких температурах вылупляются самцы, а при высоких- самки, в то время как при средней температуре в кучах в природных условиях соотношение равно 1:1. Цыплята при низких температурах весят меньше, что, вероятно, сказывается на выживаемости потомства. Megapodes имеют гетероморфные половые хромосомы как и другие птицы, что исключает температуро-зависимое определение пола, какое описано у рептилий, как механизмa смещающей половое соотношение при высоких и низких температурах. Взамен, Goth и Booth (2005) предполагают наличие температуро-чувствительной смертности эмбрионов, поскольку смертность была выше при низких и высоких температурах, и минимальной при средней температуре, при которой половое соотношение было 1:1.
Возле соединения вагины и скорлуповой железы у самок находяться глубокие железы,
обложенные простым столбчатым эпителием. Это- канальцы для хранения спермы, названные так потому, что в них может храниться сперма продолжительное время (10
дней до 2 недель). После отложения яйца, некоторые из этих спермиев могут выйти из канальцев в просвет яйцевода, и мигрировать дальше для оплодотворения следующего яйца
 Сперма птиц |

Канальцы для хранения спермы птиц |
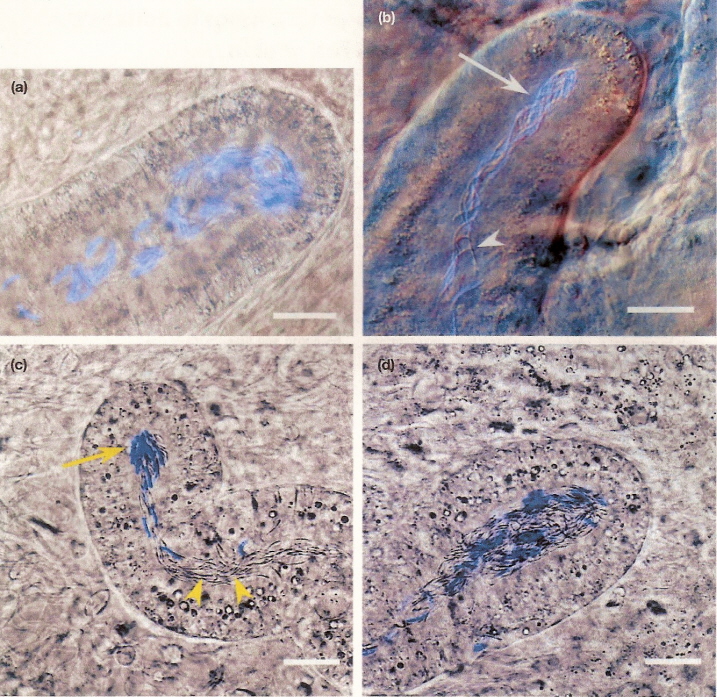
Микрофотография канальцев для хранения спермы, содержащие окрашенные и неокрашенные сперматозоиды из
домашних цыплят (Gallus domesticus)
кур (a, b) и индеек (Meleagris gallopavo) самки (c, d). Стрелками указаны окрашенные сперматозоиды;
наконечниками стрелок указаны неокрашенные сперматозоиды.
Масштабная линейка = 25 micrometers. Из: King et al. (2002).
King et al. (2002) обнаружили, что сперматозоиды из двух различных осеменений (один с окрашенной спермой, другой с неокрашенной спермой) обычно изолируются в различные канальцы как у кур, так и у индеек. Канальцы, содержащие смешанные популяции сперматозоидов были найдены только у 4% цыплят и 12% индеек. Они заключили, что не срабатывает механизм преимущества последнего самца благодаря отсутствию наслоения сперматозоидов в канальцах.
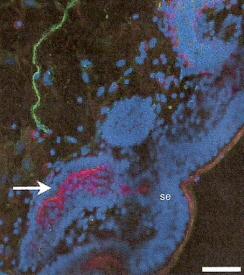 |
Иннервация канальцев для хранения спермы (Freedman et al. 2001) – Иммуногистохимическое окрашивание влагалишно-маточного соединения у индейки и канальцев для хранения спермы. Эта микрофотография показывает флуоресцирующий нейрон (зеленый) возле канальца со спермой (SST). Голубые области (se)-это поверхностный эпителий, выстилающий просвет влагалишно-маточного соединения канальцев для хранения спермы. Стрелка показывает на области, окрашенные в пурпурный цвет SST, что указывает на присутствие актина (протеин, характерный для гладких мышц. Общий размер микрофотографии 19 микрометров в поперечнике. Эта связь между нейронами и SST говорит в пользу того, что SST иннервируются и что хранение и выделение спермы из SST может контролироваться. |
События после осеменения (Birkhead and Brillard 2007) -- Большинство птиц не имеют фаллоса и, у этих видов осеменение происходит через, так называемый ‘поцелуй клоаки.’ В зависимости от таксона, сперма эякулируется в клоаку или вагину и надеется на свою подвижность, чтобы достичь многочисленных канальцев для хранения спермы (SST), расположенных на границе между маткой и влагалищем. Вследствие селекции в ходе миграции через вагину, только 1–2% осемененной спермы входит в SST, остальные, вероятно, выбрасываются во время дефекации самки. SST содержит только морфологически нормальную сперму, показывая, или, что, только нормальная сперма способна пересечь вагину, или, что только нормальная сперма ‘принимается’ SST. Точно не известно, но небольшое количество спермы движется к воронке яйцевода (место оплодотворения), не входя в SST, хотя они, вероятно, оплодотворяют только одно яйцо.
Вся сперма в SST располагается головками направленными в сторону дистального конца канальца что означает, что выход из SST является пассивным. Сперма теряется из SST более или менее постоянно с определенной скоростью. Сперма входит в матку и пассивно передвигается к воронке. Сперма аккумулируется или медленно движется через воронку так, что обычно всегда имеется популяция сперматозоидов, готовая оплодотворить каждое яйцо при овуляции. После овуляции, яйцо захватывается воронкой, приспособленной для этого, и рой сперматозоидов окружает поверхность яйца; их цель- зародышевый диск, который содержит женский пронуклеус. На этой стадии яйцо окружается внутренними перивителиновыми слоями (IPVL). Скопления спермы и дырки, проделанные в IPVL вокруг зародышевого диска свидетельствует о том, что сперма, возможно использует химические сигналы для нахождения зародышевого диска.
В отличие от большинства других таксонов, где только один спермий проникает в яйцо, у птиц полиспермия – обычное явление. Несколько спермиев проникают в район зародышевого диска, растворяя IPVL при помощи акросомной реакции спермия. Освобождение ферментов из акросомы спермия дает возможность ядру спермия проникнуть в яйцо. Однако, только один сперматозоид сливается с пронуклеусом самки, а остальные спермии смешаются к периферии зародышевого диска и дальше в развитии не участвуют. Оплодотворение включает проникновение яйца спермой и слияние мужской и женской пронуклеусом (syngamy). Поскольку развитие эмбриона начинается почти сразу же, ко времени окружения яйца яйцевыми оболочками зародыш состоит из большого количества клеток.
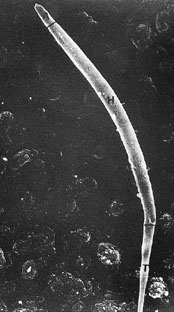 Сканирующая электронная микрофотография of a сперматозоида волнистого попугая. A акросома; H, головка; и T, хвост (начальное увеличение Ч20000) (Samour 2002). |
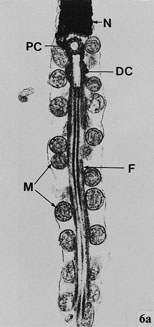 Трансмиссионная электронная фотография продольного разреза части ядра и среднего участка сперматозоида волнистого попугая. N - ядро; PC - проксимальная центриоль; DC- дистальная центриоль; F- аксиальный волокнистый комплекс; и M- митохондрия (начальное увеличение Ч30000) (Samour 2002). |
Оплодотворение яйца обычно происходит в воронке яйцевода.
Световая микрофотография яйца волнистого попугая с
многочисленными сперматозоидами на поверхности
(начальное увеличение Ч215) (Samour
2002).
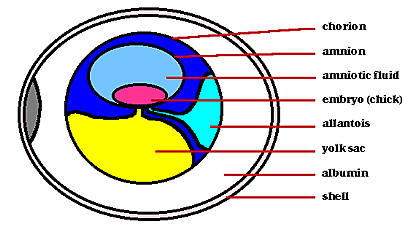
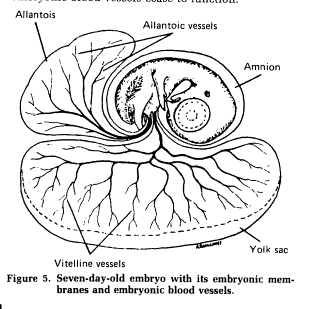
Яйца птиц, также как и сами птицы сильно различаются по размерам. Самые крупные яйца откладывают страусы. Их размеры > 2000 разов больше чем самые маленькие яйца калибри(см. фото справа; Источник: http://www.pma.edmonton.ab.ca/vexhibit/eggs/vexhome/sizeshap.htm). Яйца страусов имеют 180 mm в длину и140 mm в ширину и весят 1.2 kg. Яйца калибри- 13 mm в длину и 8 mm в ширину и весят только пол грамма. Исчезнувший птица слон из Мадагаскара откладывал яйца в 7 раз крупнее чем страус! Внутри яйца жизнь эмбриона обеспечивает три внеэмбриональные мембраны &
Состав яйца и фенотип цыплят --
Вклад родителей в яйца и, следовательно, в потомство, может значительно влиять на фенотип, выживаемость и эволюционную приспособленность организма.
Яйца птиц – прекрасная модельная система для изучения материнского энергетического вклада, переданного через вариации размеров яйца. Dzialowski1и Sotherland
(2004) использовали природный разброс по размерам яйца у эму(Dromaius novaehollandiae), от 400 g до >700 g, для проверки влияния материнского вклада в яйца на морфологию и физиологию новорожденных страусят. Самки эму снабжают более крупные яйца большим количеством энергии, питательными веществами и водой в желтке и белке. Различия в материнском вкладе отражались в различиях размеров страусят, которые увеличивались с размерами яйца. Размер яиц также повлиял на физиологию растущих эмбрионов, так, уровень метаболических реакций эмбриона находились в позитивной связи с размерами яйца и эмбрионы, развивающиеся в крупных яйцах потребляли больше желтка в ходе развития. Из больших яиц вылуплялись более тяжелые страусята (чистый вес без желтка и сухая масса) и структурно крупнее
 abc.net.au/schoolstv/animals/EMUS.htm |

Яйцо и эмбрион эму
http://www.digimorph.org/specimens/Dromaius_novaehollandiae/egg/
| Желток содержит материнские антитела -- Антитела откладываются в яйце во время формирования желтка в виде иммуноглобулинов, сперва- IgY (также называемый IgG), в желтке. У цыплят (Gallus domesticus), материнские IgY используются потомством в первые 14 суток жизни и, к 5 суткам после лупки цыплята начинают синтезировать свои собственные IgY. В результате, после около двух недель жизни циркулирующие IgY у цыплят практически имеют эндогенное происхождение. Взрослых уровней титры антител достигаются между 6 неделями и 6 месяцами жизни. Однако, материнские антитела могут и дальше продолжать оказывать влияние на скорость роста и развития. В отсутствие материнских IgY у цыплят (вследствие хирургического удаления бурсы у матери в ходе ее эмбриогенеза), количество клеток в селезенке, которые помогают лимфоцитам (helper T клетки) атака антигенов (чужеродные протеины на патогенах) подавляется. Также, подавлен иммунный ответ потомства, что может привести к снижению выживаемости потомства (Grindstaff et al. 2003). |
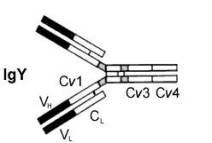 Антитела 'атакуют' патогены или токсины, которых они продуцируют путем связывания с антигенами (протеинами в мембране бактерий) через их 'участки связывания' (черные области на рисунке сверху). Это связывание может нейтрализовать токсины и привлечь белые кровяные клетки, которые элиминируют патогены (путем фагоцитоза). |

Знакомый цвет желтка куриных яиц (a) резко контрастирует с насыщенно пигментированными желтками малой чайки - черноспинки (lesser Black-backed Gull), Larus fuscus (b). Такое богатое отложение каротиноидов в желток типично среди диких видов птиц, подтверждая факт, что эти биологически активные пигменты выполняют важные функции в развитии птиц |
Почему желток желтый (или красный) (Blount et al. 2000) – Желток яйца окрашивается каратиноидами. До недавнего времени не было объяснения, почему яйцекладущие животные так обильно насыщают яйца каротиноидами. Оказывается, что в развивающемся организме каратиноиды предохраняют уязвимые ткани от разрушений, вызываемых свободными радикалами. Хотя эмбриональные ткани и зависят от окисляемых, ненасыщенных жирных кислот в желтке, их избыток делают ткани восприимчивыми к перекисному окислению, вызываемой химически активными окислительными метаболитами и свободными радикалами, которые продуцируются как нормальные промежуточные продукты метаболизма. Защита против перекисного окисления липидов у цыплятn осуществляется каротеноидами желтка и другими антиоксидантами, такими как витамин E. Антиоксиданты также защищают пассивно приобретенные антитела (IgY) против разрушения. Таким образом, материнский вклад в состав яйца, включая каротеноиды, имеет значительное влияние на выживаемость потомства. |

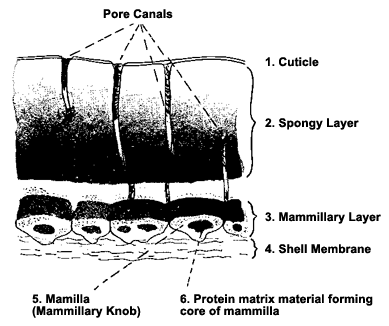


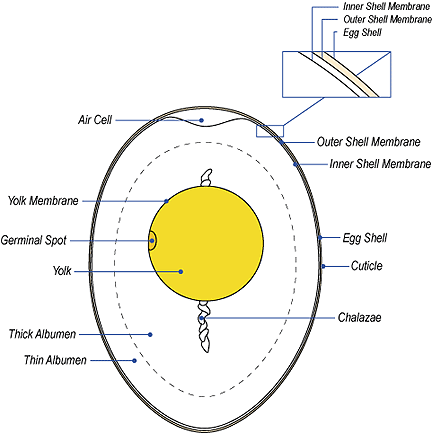
Тысячи мелких пор покрывают скорлупу, обеспечивая перенос газов.
(Source: http://www.rit.edu/~tld0898/SEM.html)
| Слабые птицы используют стероиды для помощи потомству -- Verboven et al. (2003) сообщили, что самки слабых чаек оказывают гормональную поддержку для увеличения выживаемости своих птенцов. Verboven и ее коллеги экспериментально усилили материнский эффект при помощи дачи кормовых добавок во время формирования яйца и сравнили концентрации стероидов (включая тестостерон) в их яйцах с контролем. Андрогены яйца могут влиять на продуктивность потомства непосредственно через развитие цыпленка и/или опосредованно через изменение их конкурентоспособности по сравнению с собратьями. Против ожидания, самки с экспериментально усиленным состоянием тела откладывали яйца с низким уровнем андрогенoв. Это говорит о том, что менее здоровые самки передают больше стероидов, чем здоровые чтобы усилить их производительность. Verboven заметила, что “Мы сначала думали, что чайки в хорошем состоянии отложат больше стероидов в своих яйцах. Но обнаружили, что здоровые птицы не передают в свои яйца излишнюю поддержку.” Она сравнила ситуацию с борцами-атлетами, принимающими стероиды для увеличения силы. Она добавляет: “Слабые спортсмены, возможно, хотят использовать стероиды для нивелирования своей слабости, но если вы в хорошем состоянии, то вам и не нужно принимать их.” |
 Малая чайка - черноспинка © Arthur Grosset |
|
Самки птиц создают различные фенотипы путем различных гормональных вкладов
в свои яйца -- У птиц,
самки откладывают значительные количества андрогенов в свои яйца, и экспериментальные даные показывают,
что материнские андрогены оказывают влияние на раннее развитие цыпленка. Несмотря на хорошо известную организационную роль
половых стероидов на мозг и поведение , работы в этой области ограничены в основном стадией цыпленка. Eising et al. (2005)
обнаружили, что, у чайки-черноспинки, материнские андрогены в яйце усиливают развитие брачного оперения и частоту агрессивных
и половых проявлений (см. рис. сверху) почти год спустя после лупки. Этот продолжительный эффект может быть опосредован
регуляцией рецепторов андрогенов на поздних этапах жизни. Или же, ранняя гормональная обработка могла влиять на
ось:гипоталамус-гипофиз-гонады, приведя к усилению продукции андрогенов во взрослой жизни. Эти долговременные эффекты
андрогенов яйца также благотворны для дарвиновской адекватности. Удачное занятие территории и ее защита с помощью агрессивного
поведения важны для успеха воспроизводства у колониальных птиц.
Кроме того, эти проявления важны для выбора партнера. Ясно, у птиц материнский гормональный вклад в яйца может значительно
влиять на индивидуальные различия признаков связанных с приспособлением. Поскольку эти гормоны подавляют раннюю иммунную
функцию цыпленка и снижают продолжительность жизни, матери сталкиваются с компромиссом между производством потомков с
низкой выживаемостью, но высоким репродуктивным потенциалом на год, или высокие шансы на долгожительство, но низкий
ежегодный репродуктивный потенциал. Путем производства яиц, которые отличаются по уровню материнских гормонов, самки,
вероятно, производят различные фенотипы, что, возможно является адаптивной стратегией в непредсказуемых условиях окружающей
среды. Поскольку природная селекция действует при таких фенотипических вариациях, формируя демографию популяции,
роль материнских андрогенов в этом селекционном процессе может быть значительно больше, чем считалось раньше. |
Цитированная литература:
1. Eyal-Giladi H., Kochav S. 1976 From cleavage to primitive streak formation: A complementary normal table and a new look at the first stages of the development of the chick I. General morphology // Developmental Biology. – 1976. – 49 – С. 321–337.
2. Kagami H., Clark M.E., Verrinder Gibbins A.M. & Etches R.J. Sexual differentiation of chimeric chickens containing ZZ and ZW cells in the germline // Molecular Reproduction and Development. – 1995. – 42. – С. 379–387.
Akins, C. & M. Burns. 2001. Visual control of sexual behavior. In R. G. Cook (Ed.), Avian visual cognition [On-line]. Available: www.pigeon.psy.tufts.edu/avc/akins/
Birkhead, T. R. and J.-P. Brillard. 2007. Reproductive isolation in birds: postcopulatory prezygotic barriers. Trends in Ecology and Evolution 22: in press.Blas, J., L. Perez-Rodriguez, G. R. Bortolotti, J. Vinuela, and T. A. Marchant. 2006. Testosterone increases bioavailability of carotenoids: insights into the honesty of sexual signaling. Proceedings National Academy of Sciences 103: 18633-18637.
Blount, J. D., D. C. Houston, and A. P. Mшller. 2000. Why egg yolk is yellow. Trends in Ecology and Evolution 15: 47-49.
Brown, C.R. and M. B. Brown. 2003. Testis size increases with colony size in cliff swallows. Behavioral Ecology 14:569-575.
Dzialowskil, E. M. and P. R. Sotherland. 2004. Maternal effects of egg size on emu Dromaius novaehollandiae egg composition and hatchling phenotype. J. Exp. Biol. 207:597-606.
Eising, C. M., W. Mьller & T. G.G. Groothuis. 2005. Avian mothers create different phenotypes by hormone deposition in their eggs. Proc. Royal Soc. London, Biol. Letters: early on-line.
Ellegren, H. 2001. Hens, cocks and avian sex determination: a quest for genes on Z or W? European Molecular Biology Organization Reports 2:192-196.
Ezaz, T., R. Stiglec, F. Veyrunes, and J. A. Marshall Graves. 2006. Relationships between Vertebrate ZW and XY Sex Chromosome Systems. Current Biology 16: R736-R743.
Freedman, S. L., V. G. Akuffo, and M. R. Bakst. 2001. Evidence for the innervation of sperm storage tubules in the oviduct of the turkey (Meleagris gallopavo). Reproduction 121: 809-814.
Goth, A. and D. T. Booth. 2005. Temperature-dependent sex ratio in a bird. Biology Letters 1: 31-33.
Grindstaff, J. L., E. D. Brodie III, and E. D. Ketterson. 2003. Immune function across generations: integrating mechanism and evolutionary process in maternal antibody transmission. Proc. Royal Soc. Lond. B 270: 2309-2319.
Kilner, R. M. 2006. The evolution of egg colour and patterning in birds. Biological Reviews 81: 383–406.
Haftorn, S. 1996. Egg-laying behavior in tits. Condor 98:863-865.
King, L.M., J. P. Brillard, W.M. Garrett, M.R. Bakst, and A.M. Donoghue. 2002. Segregation of spermatozoa within sperm storage tubules of fowl and turkey hens. Reproduction 123:79-86.
Pettingill, O.S., Jr. 1985. Ornithology in Laboratory and Field, Fifth ed. Academic Press, New York, NY.
Pitcher, T. E., P. O. Dunn & L. A. Whittingham. 2005. Sperm competition and the evolution of testes size in birds. Journal of Evolutionary Biology 18: 557-567.
Rosenzweig, M.R., A.L. Leiman and S.M. Breedlove. 1996. Biological Psychology. Sinauer Associates, Sunderland, MA.
Rutstein, A.N., P. J. B. Slater, and J. A. Graves. 2004. Diet quality and resource allocation in the zebra finch. Proc. R. Soc. Lond. B (Suppl.). Published online, 20 February 2004.
Saether, S. A., P. Fiske, & J. A. Kalas. 2001. Male mate choice, sexual conflict and strategic allocation of copulations in a lekking bird. Proceedings of the Royal Society London B 268: 2097 - 2102.
Samour, Jaime H. 2002. The Reproductive Biology of the Budgerigar (Melopsittacus undulatus): Semen Preservation Techniques and Artificial Insemination Procedures. Journal of Avian Medicine and Surgery 16: 39-49.
Sato, T., Yen-nien Cheng, Xiao-chun Wu, D. K. Zelenitsky, & Yu-fu Hsiao. 2005. A Pair of Shelled Eggs Inside A Female Dinosaur. Science 308:375.
van der Molen, W. H. 2002. Laying an egg. http://www.afn.org/~poultry/egghen.htm.
Verboven, N., P. Monaghan, D.M. Evans, H. Schwabl, N. Evans, C. Whitelaw, and R.G. Nager. 2003. Maternal condition, yolk androgens and offspring performance: a supplemental feeding experiment in the Lesser Black-backed Gull (Larus fuscus). Proceedings of the Royal Society: Biological Sciences 270: 2223 - 2232.
Welty, J.C. and L. Baptista. 1988. The life of birds, fourth ed. Saunders College Publishing, New York, NY.
Wingfield, J. C., and T. P. Hahn. 1994. Testosterone and territorial behaviour in sedentary and migratory sparrows: Animal Behaviour 47: 77–89.
Wingfield, J. C., J. D. Jacobs, A. D. Tramontin, N. Perfito, S. Meddle, D. L. Maney, and K. Soma. 2000. Toward and ecological basis of hormone-behavior interactions in reproduction of birds: In K. Wallen and J. Schneider (eds.), Reproduction in context, pp. 85–128. MIT Press, Cambridge.
Winterbotton, M., T. Burke, & T. R. Birkhead. 2001. The phalloid organ, orgasm and sperm competition in a polygandrous bird: the red-billed buffalo weaver. Behavioural Ecology and Sociobiology 50: 474-482.
Useful Links:
Form and Function - A Closer Look at the Chicken Egg Shell
Hormonal Control of Incubation/Brooding Behavior: Lessons from Wild Birds
